La química es la ciencia que estudia la materia, sus propiedades, composición, reactividad y las transformaciones que experimenta, Así como las leyes que rigen esos cambios
Competencia general. Argumenta las bases teórico - prácticas del campo de la química fundamental; mediante principios
que las relacionen en su vida cotidiana y la preservación del entorno; con una visión hacia el desarrollo
sustentable.
 |
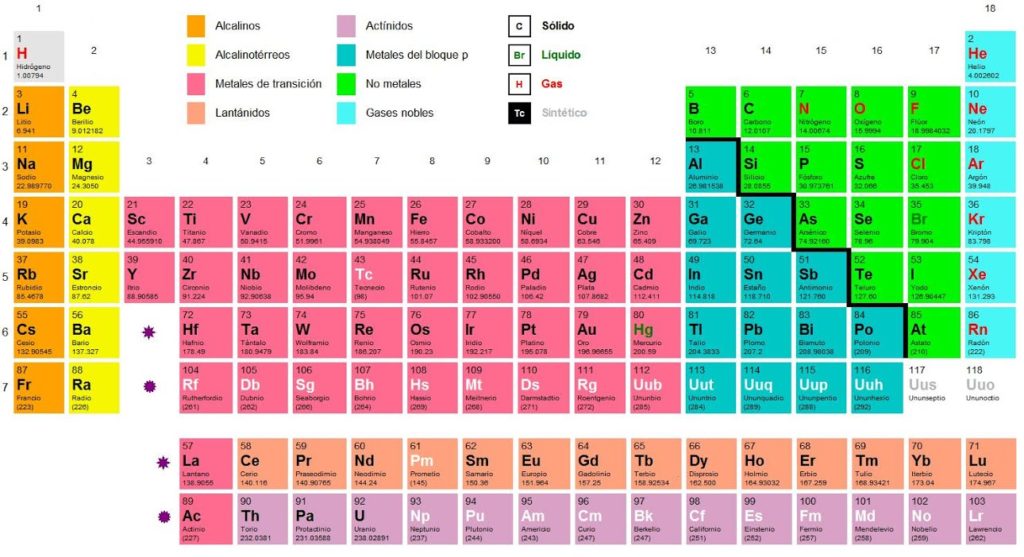
| Tabla periódica |
1.- MATERIA:
-Conceptos de Materia. Masa. Energía.
-Ley de la conservación de la masa, Ley de la conservación de la energía, Ley de la conservación de la
materia.
materia.
- Concepto de energía potencial y de energía cinética. Manifestaciones de la energía.
-Análisis sobre el uso irracional de la energía. Estados de agregación de la masa.
-Cambios de estado.
-Propiedades generales de la masa (materia).
-Propiedades Específicas de la masa (materia). Físicas y Químicas.
-Ejemplos. Fenómenos Físicos y Químicos. Ejemplos. Sustancias puras (Elementos y compuestos).
-Ejemplos. Mezclas. Homogéneas y heterogéneas.
-Ejemplos. Métodos de separación de mezclas.
2.- ESTRUCTURA ATÓMICA
* Átomo. Breve historia de los modelos atómicos: Modelo de Dalton, Modelo de Thomson, Modelo de
Rutherford.
* Modelo de Bohr. Modelo cuántico.
* Partículas Subatómicas (protón, neutrón y electrón).
* Número Atómico, Número de masa.
* Ejercicios sobre el cálculo de números de protones, electrones y neutrones que presenta el átomo de
algún elemento específico.
UNIDAD 4. ENLACE QUÍMICO.
* Isótopos. Uso de los isótopos.
* Teoría cuántica. Átomo de Bohr. Estado basal y estado excitado.
* Isótopos. Uso de los isótopos.
* Teoría cuántica. Átomo de Bohr. Estado basal y estado excitado.
* Principio de incertidumbre de Heisenberg.
* Números cuánticos. Significado.
* Tabulación de los valores de los números cuánticos. Principio de máxima multiplicidad (regla de
Hund);
Hund);
* Principio de edificación progresiva (regla de AUFBAU); Principio de exclusión de Pauli.
* Configuración electrónica. Diagrama energético.
Determinación del valor de los cuatro números cuánticos con base al electrón diferencial.
3.- TABLA PERIÓDICA:
* Clasificación de los elementos por: Periodo Grupo y familia Clase .
* Tipo de elemento (representativos, de transición y de transición interna.
* Metales y No metales Propiedades y diferencias Importancia socio – económico - ecológica de
algunos elementos químicos.
* Propiedades periódicas Electronegatividad Actividad química Valencia y Número de oxidación.
4.- ENLACE QUÍMICO
* Concepto de enlace químico.
* Regla del octeto Símbolos y estructuras de Lewis Tipos de enlace:
a) Iónico o electrovalente
b) Covalente: Polar, no polar y coordinado.
c) Metálico. Propiedades de las sustancias en función del tipo de enlace
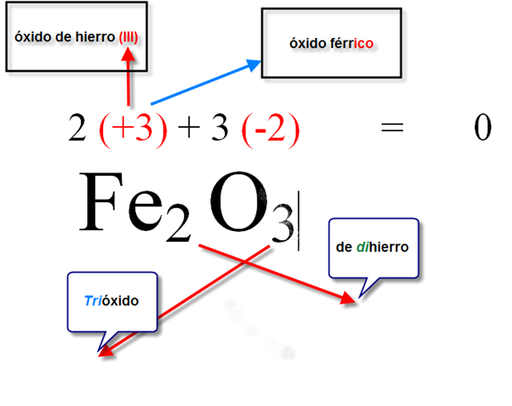
5.- NOMENCLATURA QUÍMICA INORGÁNICA
Nomenclatura IUPAC de funciones químicas inorgánicas. Uso de nomenclatura común:
- Óxidos metálicos y óxidos no metálicos
- Hidróxidos o bases.
c) Hidrácidos y oxiácidos.
d) Sales binarias y oxisales.
e) Hidruro
f ) Sales ácidas.
d) Sales binarias y oxisales.
e) Hidruro
f ) Sales ácidas.
UNIDAD 1.- MATERIA
Competencia particular: Plantea medidas preventivas y correctivas para el uso racional de la masa y la energía en su entorno socio ecológico.
RAP 1:
Maneja las sustancias relacionando la química con otras ciencias y la vida cotidiana.
RAP 2:
Propone alternativas sobre el uso de las diferentes fuentes energéticas, considerando las consecuencias
de su manejo irracional.

UNIDAD 2.- ESTRUCTURA ATÓMICA
Competencia particular: Emite juicios de valor sobre los beneficios y repercusiones del uso del átomo en los diferentes campos de la ciencia integrando los fundamentos de la mecánica cuántica.
RAP 1: Predice la estructura del átomo empleando modelos atómicos para caracterizar los diferentes elementos
químicos.
RAP 2:
Explica la construcción de la tabla periódica tomando como base la determinación de los cuatro números cuánticos.
UNIDAD 3. TABLA PERIÓDICA.
Competencia particular 3 (Unidad III): Maneja la tabla periódica como fuente de información básica con enfoque CTSA (Ciencia – Tecnología – Sociedad – Ambiente).
RAP 1: Demuestra cómo se construyo la tabla periódica a partir del empleo de la distribución electrónica.
RAP 2: Predice las propiedades de los elementos químicos a partir de la tendencia de las propiedades
https://youtu.be/PsW0sGF5EBE
UNIDAD 4.- ENLACE QUÍMICA
Competencia particular: Propone productos con base en el tipo de enlace químico, para una aplicación específica en la vida cotidiana.
RAP 1: Explica el proceso de unión química utilizando modelos gráficos y deduciendo las propiedades de las
sustancias resultantes.
sustancias resultantes.
RAP2: Predice el comportamiento de diferentes sustancias con base en las propiedades derivadas del tipo de
enlace químico, considerando la preservación del medio ambiente.
enlace químico, considerando la preservación del medio ambiente.
NOMENCLATURA QUÍMICA INORGÁNICA
Competencia particular.
Emplea el lenguaje químico para nombrar y escribir diferentes compuestos inorgánicos identificándolas para su uso y evitando riesgos en su entorno.
RAP1:
Traduce de un lenguaje verbal a uno simbólico o viceversa el nombre o fórmula de un compuesto
inorgánico para una comunicación adecuada en diferentes contextos.
Traduce de un lenguaje verbal a uno simbólico o viceversa el nombre o fórmula de un compuesto
inorgánico para una comunicación adecuada en diferentes contextos.
RAP 2: Emite juicios de valor sobre los beneficios y repercusiones socioeconómicas y ecológicas de
diferentes compuestos inorgánicos en el país.
diferentes compuestos inorgánicos en el país.
https://youtu.be/hE2EYR8561Y
https://youtu.be/9aBz8SWUXso
https://youtu.be/YWpc3xsrkKQ
ÁREA DE LA MATERIA:
La materia de química se encuentra dentro del área básica del nivel medio superior del IPN en el CECyT 4 "Lázaro Cárdenas"
JEFE DE ÁREA:
Araceli Ramirez Castro.
PRESIDENTE DE ACADEMIA :
-Felipe Francisco Melgoza Valencia
PROFESORES QUE IMPARTEN LA MATERIA:
-Rosalba Hernández Gonzalez
-Jorge Genaro López Rámirez
-Marta Angelica Bonilla Vazquez
-Laura Carranza Calderon
-María Lourdes Magdalena Garcia Navez


https://youtu.be/YWpc3xsrkKQ
INFORMACIÓN DE LA MATERIA:
La materia de química se encuentra dentro del área básica del nivel medio superior del IPN en el CECyT 4 "Lázaro Cárdenas"
JEFE DE ÁREA:
Araceli Ramirez Castro.
PRESIDENTE DE ACADEMIA :
-Felipe Francisco Melgoza Valencia
PROFESORES QUE IMPARTEN LA MATERIA:
-Rosalba Hernández Gonzalez
-Jorge Genaro López Rámirez
-Marta Angelica Bonilla Vazquez
-Laura Carranza Calderon
-María Lourdes Magdalena Garcia Navez
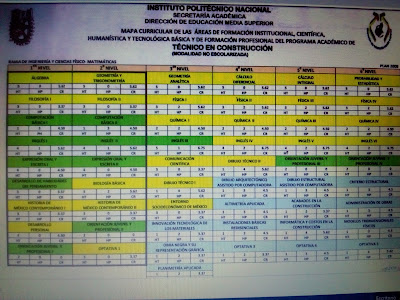
MAPA CURRICULAR:
UBICACIÓN
THE ATOM
The atom is the basic unit of chemistry. It is made up of a dense nucleus called the atomic nucleus,
which is surrounded by a space called the "electron cloud." The nucleus is made up of positively
charged protons and uncharged neutrons (both called nucleons). The electron cloud is electrons that
revolve around the nucleus negatively charged.
In a neutral atom, negatively charged electrons balance the positive charge of the protons.
The nucleus is dense; The mass of a nucleus is 1836 times greater than that of an electron,
however, the radius of an atom is approximately 10,000 times greater than that of its nucleus 33 34
The atom is the smallest entity that should be considered to preserve the chemical properties
of the element, tales such as electronegativity, ionization potential, preferred oxidation states,
coordination numbers and types of bonds that an atom form (metallic , ionic, covalent, etc.).


BIBLIOGRAFIA






¡Bien equipo de Química! Son el primer equipo que sube información al blog.
ResponderBorrarSuban el resto de la información que les pedí.
¡Gracias!
Falta:
ResponderBorrar-Justificar los textos.
-Ajustar las imágenes al tamaño de la presentación.